 更新时间:2022-07-11
更新时间:2022-07-11 点击次数:1136
点击次数:1136
稳定性试验的基本要求是:
1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用1批原料药进行。加速试验与长期试验要求用3批供试品进行。
2)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。
如何选择药物的稳定性试验箱?重要是要能满足药物(含原料药或药物制剂)相关ICH法规及《中华人民共和国药典》2015年版第四部或者更新版本的要求。
一.影响因素试验
此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件与建立降解产物的分析方法提供科学依据。一般包括高温、高湿、强光照射试验,一般将原料药供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚的薄层进行试验。对于口服固体制剂产品,一般采用除去内包装的小制剂单位,分散为单层置适宜的条件下进行。如试验结果不明确,应加试两个批号的样品。
1.高温试验
供试品开口置适宜的洁净容器中,在60℃±2℃条件下放置10天,于第5天和第10天取样,检测有关指标。如供试品发生显著变化,则在40℃±2℃下同法进行试验。如60℃无显著变化,则不必进行40℃试验。

2.高湿试验
供试品置恒湿密闭容器中,于25℃分别于相对湿度75%±5%及90%±5%条件下放置10天,在第5天和第10天取样检测。检测项目应包括吸湿增重项。液体制剂可不进行此项试验。
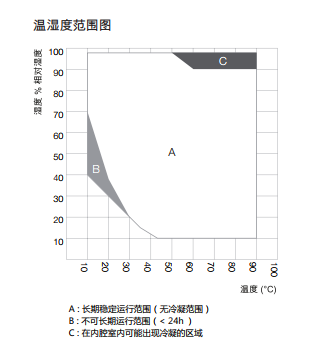
BINDER KMF系列相图
3.光照试验
供试品开口置在光照箱或其它适宜的光照容器内,于照度4500Lx±500Lx条件下放置10天(总照度量为120万Lxh),在第5天和第10天取样检测,有条件时还应采用紫外光照射。光照试验的总照度不低于1.2×106Lux·hr、近紫外能量不低于200w·hr/m2。
二.加速及长期试验:
加速及长期试验的放置条件
| 研究项目 | 放置条件 | 申报数据涵盖的 短时间 |
| 长期试验 | 25℃±2℃/60%RH±5%RH或30℃±2℃/65%RH±5%RH | 新制剂12个月 仿制制剂6个月 |
| 中间试验 | 30℃±2℃/65%RH±5%RH | 6个月 |
| 加速试验 | 40℃±2℃/75%RH±5%RH | 6个月 |
拟冷藏的制剂
| 研究项目 | 放置条件 | 申报数据涵盖的短时间 |
| 长期试验 | 5℃±3℃ | 12个月 |
| 加速试验 | 25℃±2℃/60%RH±5%RH | 6个月 |
拟冷冻贮藏的制剂
| 研究项目 | 放置条件 | 申报数据涵盖的短时间 |
| 长期试验 | -20℃±5℃ | 12个月 |
| 加速试验 | 5℃±3℃或25℃±2℃ | 6个月 |
用户根据药品的性质,可以选择如下型号的恒温恒湿箱。
在加速试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性重点考察项目检测;长期试验中,每3个月取样一次,分别于0个月、3个月、6个月、9个月、12个月取样按稳定性重点考察项目进行检测。这样要求恒温恒湿试验箱需要采用压缩机制冷技术而非半导体技术,确保开关门恢复时间短。

当你的药物、生物医药相关设备或者信息系统需要销售给美国的制药企业和研究人员都应该符合FDA 21 CFR Part 11的规定。需要选配相应的符合FDA 21 CFR Part 11的GLP 软件系统。
稳定性中使用的稳定性试验箱要经过验证(IQ、OQ、PQ)或校验合格。相应的验证方案和报告都要齐全完整。稳定性试验箱的管理要有SOP进行规定,哪些人员负责日常检查?哪些人有权限进入稳定性考察室?哪些人负责填写记录(样品放置、样品取出),如果遇到突然断电、缺水、漏水、缺打印纸、湿度超限……这些问题该如何处理,是否有应急措施和方案,如UPS电源。所有保证样品在正常放置条件下的工作都要考虑到位。
恒温恒湿箱作为宾德BINDER的明星产品,进入中国市场多年,积累了广大的用户基础并享有*的声誉。全新一代恒温恒湿箱搭载超大触摸式控制面板,方便用户调整及实时监测实验数据。出于对数据信息安全的考虑,还设置了密码锁及分级管理等一系列安全设置. “为您的成功创造的条件”是BINDER的理念,BINDER致力于为客户提供的产品、服务以及专业的咨询。
Copyright © 2025 东南科仪版权所有 备案号:粤ICP备07011256号
技术支持:化工仪器网 管理登录 sitemap.xml